一、什么是疏水色谱?
蛋白等大分子电解质在不含盐的水溶液中,由于同种电荷会发生静电相互排斥作用,因此溶解度不高。添加盐会削弱静电排斥作用并提高溶解度,即所谓salt in(盐溶)现象。进一步提高盐浓度,与蛋白结合(水和)并稳定其溶解的水会被盐夺走。其结果是,被水和覆盖的疏水部位露出,引起彼此之间的疏水相互作用并开始沉淀,即所谓salt out(盐析)现象。在疏水色谱中,使用高浓度盐的流动相,在导入了疏水性官能团的填料和分析样品之间产生疏水性相互作用,使得样品组分结合到填料上。其后,逐渐降低盐浓度,疏水性相互作用减弱,分析样品从填料中被洗脱出来。分析样品不同组分其相互作用的程度不同,因此,可在不同盐浓度下发生洗脱。氨基酸组成和立体结构是决定疏水性的重要原因,同时疏水相互作用和分子尺寸之间也有较弱的关联。一般而言,分子量越大,疏水相互作用表现出越强(=洗脱迟缓)的趋势。
二、色谱柱(填料)的选择
官能团的种类和疏水性的强弱如下图所示。虽然疏水性的强弱基本取决于官能团,但还是会受到键合密度的影响,密度越高,疏水性越高。另外,芳香族官能团和脂肪族官能团,受π电子引起的相互作用的影响,选择性上存在略微差异。
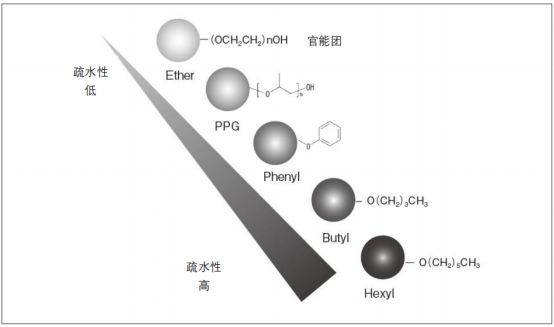
考虑分析样品向孔内部的渗透、扩散引起的传质效应,一般选择较大孔径的(例如,约100 nm)填料。但在纯化过程中,考虑到效率,有时也会选择对实际分析样品吸附载量最大所对应孔径的填料。TOYOPEARL Phenyl-600、PPG-600、Butyl-600等600系列的孔径设计为75 nm左右,大多用于分子尺寸与抗体相同或类似的分析样品的纯化。TOYOPEARL Butyl-550的孔径设计得较小,约为50 nm,适用于小分子蛋白和肽的纯化。疏水色谱中使用的基质如下表所示。非多孔性填料是在无孔聚合物基质填料表面导入了疏水官能团的高速、高分辨率用填料。无需考虑向孔内的扩散,因此适用于所有分子尺寸的分析样品。然而非多孔性填料的有效表面积较小,导致样品载量较少,同时还需要注意杂质可能造成的污染。
使用梯度洗脱时,色谱柱长度对分辨率的影响较小,不需要为了提高分辨率而增大色谱柱长度。另一方面,在吸附载量较重要的纯化工艺中,色谱柱长度则对动态吸附载量有影响。特别在高流速条件下使用长度较短的色谱柱时,由于动态吸附载量较低,需要考虑处理能力时,最好采用相同的色谱柱长度(或柱床高度)或至少10 cm以上长度的色谱柱进行规模放大研究。
疏水色谱用填料基质的种类和特点
基 质 | 优 点 | 缺 点 |
聚合物类填料 (多孔性填料) | 吸附载量高 有耐碱性 易于放大 | |
聚合物类填料 (非多孔性填料) | 高速、高分辨率 有耐碱性 适用于所有分子尺寸的分析样品 | 载量低 对杂质造成的污染敏感 |
三、流动相的选择
在疏水色谱中,缓冲液的种类对选择性几乎没有影响。大多推荐使用在中性附近具有缓冲能力的20~100 mmol/L左右的磷酸盐缓冲液或Tris盐酸盐缓冲液,加入1~2 mol/L左右的硫酸铵作为流动相使用。硫酸铵价格低廉,水溶解度高,在低温条件下,溶解度也不会下降。由于选择性的不同,有时也使用硫酸钠或氯化钠。但硫酸钠在低温下溶解度会大幅下降,需要注意盐析现象。
初始盐浓度设定为分析样品不会发生沉淀的盐浓度。通常情况下,预先配制添加了多种浓度的硫酸铵(1~2 mol/L)样品,将上清液和沉淀物分别使用SDS-PAGE等,计算分析样品不发生沉淀的最高硫酸铵浓度,以该浓度作为初始流动相的盐浓度。尽量使用高盐浓度的初始流动相,盐析沉淀的杂质可以事先通过过滤器过滤和离心法去除。
分析样品的疏水性较高时,即使降低盐浓度,也无法洗脱,或峰形展宽。此时,推荐可将少量的水溶性有机溶液(例如,异丙醇等)添加到盐浓度较低的流动相中。在疏水色谱中,使用盐浓度较高的流动相,因此,添加有机溶剂时,要注意盐的析出。另外,添加有机溶剂,色谱柱压力会升高,因此还需注意压力上升,根据需要调整流速。
四、分离示例
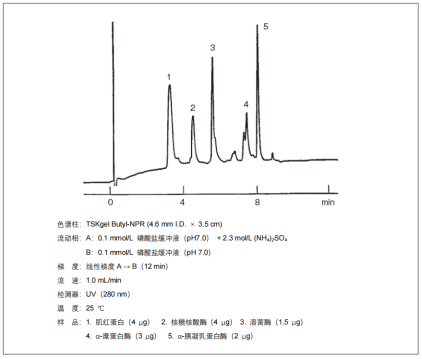
1. 标准蛋白的分离示例
标准蛋白分离示例如下图所示。大多情况下,流动相使用磷酸盐缓冲液(pH 7.0)。
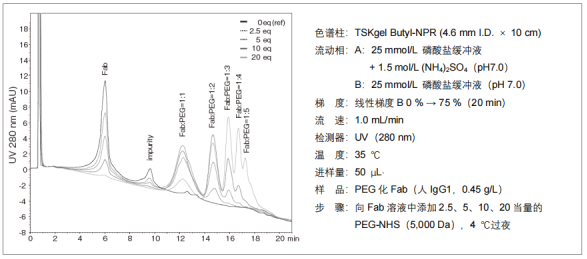
2. PEG 化蛋白的分离
导入PEG,疏水性会增大,因此可以观察到与PEG导入数相对应的色谱峰。下图显示了在木瓜蛋白酶水解后的人抗体片段(Fab)中使用PEG-N-羟基琥珀酰亚胺酯(NHS)衍生物制作的PEG化Fab的分析示例。
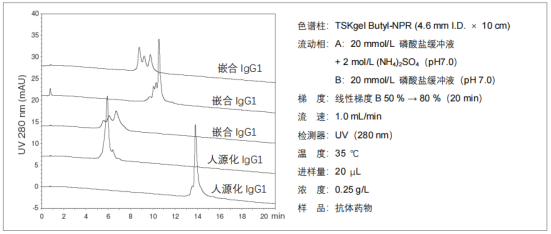
3. 抗体药物的分离
抗体异构体的分离大多使用阳离子交换色谱,但使用疏水色谱,可以得到选择性与离子交换色谱不同的结果。5种市售抗体药物的异构体分析示例如下图所示。每种抗体都分离出了多个色谱峰。
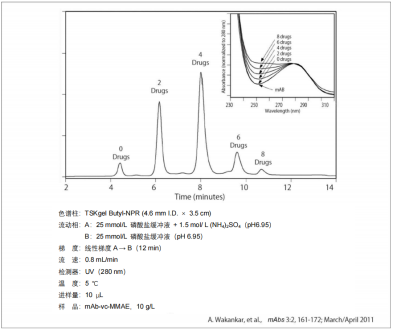
4. ADC(Antibody-drug conjugate)的分离
ADC是将抗体和小分子药物偶联到一起的药物。抗体对癌细胞等表面存在的抗原进行识别/结合,被吸收到细胞内后,在细胞内部与抗体结合的药物显示出药效,可以选择性地只杀死特定细胞。通常1个抗体偶联3~4个小分子药物。未偶联药物的抗体虽然也与抗原结合,但无小分子药物药效,只有作为抑制剂发挥作用的可能。相反,过多偶联小分子药物时,与抗原的结合能力下降,因此不建议使用。在 ADC质量管理中,关于对药物引入程度(即DAR:Drug to Antibody Ratio)的评价非常重要。
在ADC中,采用了使用抗体携带的氨基和还原SS结合生成的巯基导入药物的方法。由于大多药物的疏水性较高,因此,测定ADC中的药物偶联量时,一般采用疏水色谱。使用TSKgel Butyl-NPR分析ADC的示例如下图所示。分析结果表明,二硫键还原后生成的巯基与药物很好地偶联上了。